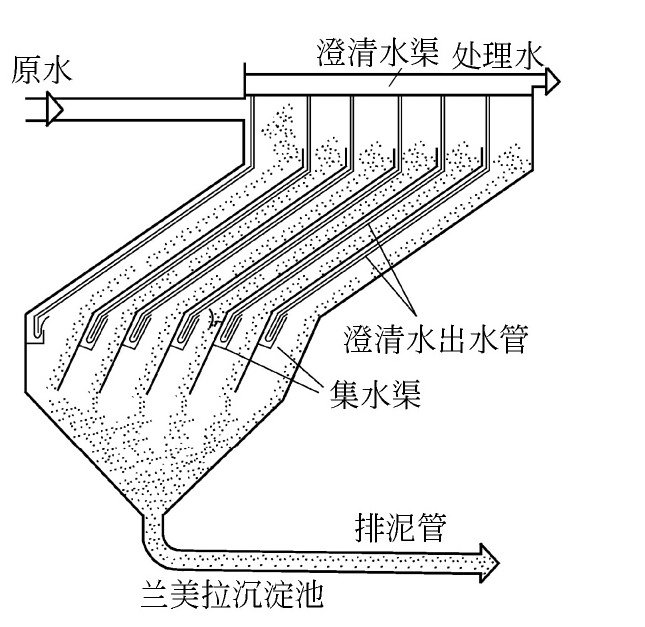
金属的腐蚀电化学反应实际上是这样的过程:首先是在溶液中的金属释放自由电子(通常把释放自由电子的氧化反应称为阳极反应);自由电子传递到阴极(接受电子的还原反应称为阴极反应);电子再由阴极传递到溶液中被其他物质吸收。因此腐蚀过程是一个发生在金属和溶液界面上的多相界面反应,同时也是一个多步骤的反应。由以上叙述中可以看出,一个腐蚀过程至少由一个阳极(氧化)反应和一个阴极(还原)反应组成。
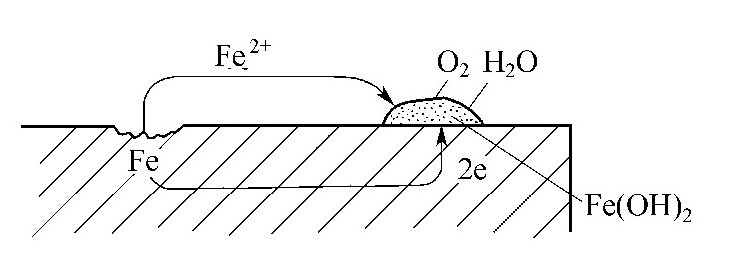
图5-2-1 铁的电化学腐蚀
碳钢在冷却水中的腐蚀是一个电化学过程。由于碳钢组织表面的不均一性,因此,当它浸入水中时,在其表面就会形成许多微小的腐蚀电池。其腐蚀过程用图5-2-1示意说明。
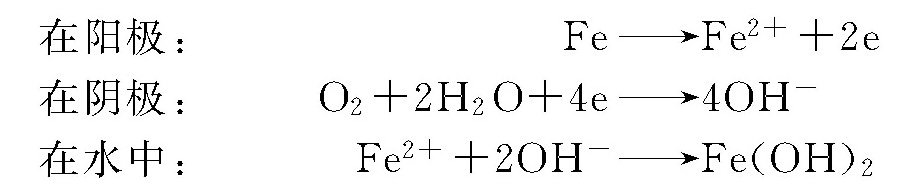
阳极区域Fe不断失去电子,变成Fe2+进入溶液,也即铁不断被溶解腐蚀,留下的电子,通过金属本体移动到阴极渗碳体的表面,与水和溶解在水中的O2起反应生成OH-。在水中,阴、阳极反应生成的Fe2+与OH-相遇即生成不溶性的白色Fe(OH)2堆积在阴极部位,铁的表面不再和水直接接触,这就抑制了阳极过程的进行。但当水中有溶解氧时,阴极部位的反应还要进行下去,因Fe(OH)2这种物质极易被氧化为Fe(OH)3,即铁锈。由于铁锈基本不溶于水,所以只要水中不断有O2溶入,这种腐蚀电池的共轭反应也就不断进行。换言之,也就是碳钢的腐蚀会不断地进行下去。
上述腐蚀电池中,阳极氧化反应和阴极还原反应必须同时进行,如其中一个反应被停止,则整个反应就会停止,故称之为共轭反应。因此,如果能设法控制其阴极过程或阳极过程,则整个腐蚀过程也就会相应的得到控制。反之,如果在阳极不断除去Fe2+或在阴极表面不断充分供给O2,则共轭反应也就会加速进行,也即腐蚀过程变快。因此,采取不同的方式控制其阴极或阳极过程,就是控制冷却水系统腐蚀的各种方法的依据。